Tabla de Contenidos
¿Cuál es la importancia de la tabla periódica de los elementos?
La tabla periódica de los elementos es una herramienta fundamental en el estudio de la química y de la ciencia en general. Su importancia radica en que proporciona una organización y clasificación sistemática de todos los elementos químicos conocidos hasta el momento, permitiendo comprender las propiedades y relaciones entre ellos. Esta organización en forma de tabla ayuda a los científicos a visualizar y analizar de manera más clara la estructura y comportamiento de los elementos.
La tabla periódica es esencial para comprender cómo se forman los compuestos químicos, cómo se combinan los átomos y cómo se llevan a cabo las reacciones químicas. Proporciona información sobre las propiedades físicas y químicas de cada elemento, como su masa atómica, configuración electrónica, número atómico, punto de fusión y ebullición, entre otros datos relevantes. Esto es vital para el diseño y desarrollo de nuevos materiales, medicamentos, productos químicos y tecnologías.
Además, la tabla periódica permite identificar patrones y tendencias en las propiedades de los elementos, lo que facilita la predicción de comportamientos y propiedades de elementos aún no descubiertos o sintetizados. Asimismo, proporciona una base sólida para la enseñanza y el aprendizaje de la química, ya que simplifica y organiza la vasta cantidad de información sobre los elementos en una estructura accesible y comprensible.
En resumen, la importancia de la tabla periódica radica en su capacidad para organizar, sistematizar y presentar de manera clara y concisa la información crucial sobre los elementos químicos. Es una herramienta fundamental tanto para la investigación científica como para la educación, y su comprensión es esencial para el avance de la química y de numerosos campos relacionados.
¿Cómo se organiza la tabla periódica en la actualidad?
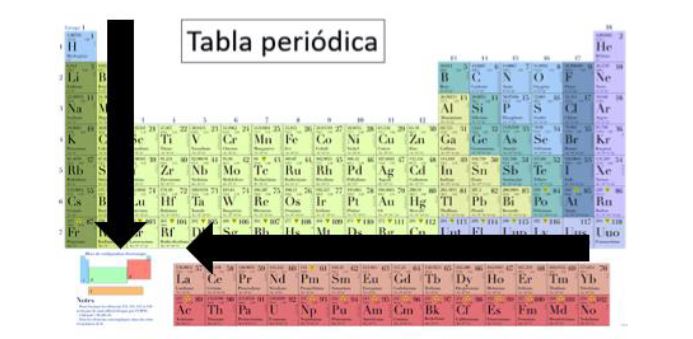
La tabla periódica en la actualidad se organiza en base a la estructura de los átomos y a las propiedades periódicas de los elementos. Está dividida en filas horizontales llamadas periodos y en columnas verticales conocidas como grupos o familias.
Los elementos están dispuestos en orden creciente de número atómico, es decir, de la cantidad de protones en el núcleo de cada átomo. Cada casilla de la tabla representa un elemento químico específico e incluye su símbolo, número atómico y, en algunos casos, su masa atómica.
Los periodos indican el número de niveles de energía o capas electrónicas que tiene cada elemento. En la tabla periódica actual, existen siete periodos, numerados del 1 al 7. A medida que se avanza en un periodo, se van llenando secuencialmente los orbitales electrónicos con electrones.
Por otro lado, los grupos o familias están formados por elementos que comparten características similares. Algunos grupos importantes son los metales alcalinos, los metales alcalinotérreos, los halógenos, los gases nobles, entre otros. Cada grupo tiene propiedades particulares que se repiten de manera regular a lo largo de la tabla periódica.
Dentro de los grupos de la tabla periódica, es común encontrar patrones en las propiedades químicas y físicas de los elementos. Por ejemplo, los metales alcalinos del Grupo 1 son altamente reactivos y tienden a perder un electrón para formar cationes con una carga positiva de +1. Los halógenos del Grupo 17, por otro lado, son altamente electronegativos y tienden a ganar un electrón para formar aniones con una carga negativa de -1.
Además de los periodos y grupos, la tabla periódica se divide en bloques según la forma en que se llenan los orbitales electrónicos. Estos bloques son el bloque s, el bloque p, el bloque d y el bloque f. Los bloques s y p son los más comunes y están relacionados con los elementos en los periodos más cortos de la tabla periódica.
La tabla periódica también cuenta con una separación en la parte central conocida como línea de separación o escalón de elementos. Esta separación se realiza para agrupar a los elementos según sus propiedades metálicas o no metálicas. A la izquierda de la línea se encuentran los metales, mientras que a la derecha se encuentran los no metales y los metaloides, que tienen características intermedias entre los metales y los no metales.
En resumen, la tabla periódica se organiza en periodos y grupos, basándose en el número de niveles de energía y en las propiedades químicas y físicas de los elementos. Esta organización permite identificar patrones y tendencias en las propiedades de los elementos, facilitando su estudio y comprensión. Los bloques y la línea de separación también proporcionan información adicional sobre las características de los elementos en la tabla periódica.
¿Dónde puedo encontrar una tabla periódica actualizada en formato PDF?
Si estás buscando una tabla periódica actualizada en formato PDF, tienes varias opciones disponibles para acceder a este recurso de manera gratuita. Una forma conveniente de obtener una tabla periódica en formato PDF es a través de sitios web especializados en química y educación científica. Estos sitios suelen ofrecer descargas gratuitas de tablas periódicas actualizadas en diferentes formatos, incluyendo PDF.
Algunos sitios confiables donde puedes encontrar tablas periódicas actualizadas en formato PDF son:
- IUPAC (Unión Internacional de Química Pura y Aplicada): El sitio web oficial de la IUPAC proporciona una tabla periódica interactiva y descargable en formato PDF. Esta tabla periódica es actualizada regularmente y cuenta con información detallada sobre cada elemento.
- Los sitios web de universidades y organizaciones educativas: Muchas universidades y organizaciones educativas ofrecen recursos gratuitos en línea, incluyendo tablas periódicas en formato PDF. Puedes buscar en los sitios web de universidades reconocidas o en los portales educativos de tu país para encontrar tablas periódicas actualizadas en formato descargable.
- Sitios web de química y ciencia: Existen numerosos sitios web especializados en química y ciencia que ofrecen tablas periódicas en formato PDF. Estos sitios suelen proporcionar tablas periódicas con diferentes enfoques y detalles adicionales sobre los elementos. Algunos ejemplos son Chem4Kids, Royal Society of Chemistry y Lenntech.
Además, es importante mencionar que muchas aplicaciones móviles de química también ofrecen tablas periódicas actualizadas en formato digital, lo que te permite tener acceso a este recurso desde tu dispositivo móvil en cualquier momento.
Recuerda verificar la confiabilidad y la actualización de la tabla periódica que descargues, ya que es fundamental contar con información precisa y actualizada para tus estudios o investigaciones.
¿Qué es la tabla periódica y cuál es su función principal?
La tabla periódica es una representación sistemática y organizada de todos los elementos químicos conocidos. Su función principal es proporcionar una estructura que permita clasificar y ordenar los elementos de acuerdo con sus propiedades físicas y químicas, y establecer relaciones y patrones entre ellos.
La tabla periódica se compone de filas horizontales llamadas periodos y columnas verticales conocidas como grupos o familias. Cada elemento se representa mediante su símbolo químico, número atómico y, en algunos casos, su masa atómica. Estos datos proporcionan información básica sobre cada elemento y su posición dentro de la tabla.
La tabla periódica permite visualizar las tendencias periódicas en las propiedades de los elementos. Por ejemplo, a medida que se avanza de izquierda a derecha en un periodo, los elementos suelen tener una mayor electronegatividad y una menor radio atómico. Del mismo modo, al descender por un grupo, los elementos suelen tener una mayor reactividad y una mayor masa atómica.
Además de estas tendencias, la tabla periódica también muestra las relaciones entre los elementos de una misma familia o grupo. Los elementos de un grupo comparten características químicas similares debido a su configuración electrónica y su tendencia a ganar, perder o compartir electrones en reacciones químicas.
En resumen, la tabla periódica es una herramienta fundamental en la química y la ciencia en general. Su función principal es proporcionar una estructura ordenada para clasificar y organizar los elementos, y permite identificar patrones y tendencias en sus propiedades. La tabla periódica es un recurso invaluable para los químicos, estudiantes y científicos, ya que facilita la comprensión y el estudio de los elementos y su comportamiento químico.
¿Cuántos elementos químicos hay en la tabla periódica?
En la tabla periódica actualmente reconocida, existen un total de 118 elementos químicos conocidos y confirmados. Estos elementos están ordenados en función de su número atómico, que corresponde al número de protones en el núcleo de un átomo.
Los elementos de la tabla periódica van desde el hidrógeno (H) con el número atómico 1, hasta el oganesón (Og) con el número atómico 118. Cada elemento tiene propiedades químicas y físicas únicas que lo distinguen de los demás.
Es importante destacar que algunos de los elementos más pesados y menos estables solo pueden ser sintetizados en laboratorios mediante reacciones nucleares. Estos elementos sintéticos tienen una vida media muy corta y son difíciles de producir y estudiar en detalle.
La tabla periódica se expande y se actualiza periódicamente a medida que se descubren y se confirman nuevos elementos químicos. Cabe destacar que los elementos con números atómicos más altos y sintéticos tienden a ser menos estables y más difíciles de estudiar debido a su corta vida media.
En conclusión, la tabla periódica actualmente reconocida contiene un total de 118 elementos químicos, cada uno con su propio número atómico y características distintivas. Esta lista de elementos proporciona la base para la comprensión de la química y el estudio de las propiedades y comportamientos de la materia.
¿Cuáles son los grupos principales de la tabla periódica?

La tabla periódica se organiza en grupos o familias, que son columnas verticales en la tabla. Estos grupos están compuestos por elementos que comparten características y propiedades químicas similares. A continuación, se describen algunos de los grupos principales más importantes en la tabla periódica:
Grupo 1: Metales alcalinos
El grupo 1 de la tabla periódica está compuesto por los metales alcalinos. Estos elementos incluyen el hidrógeno (H), litio (Li), sodio (Na), potasio (K), entre otros. Los metales alcalinos son altamente reactivos y tienden a perder un electrón para formar iones con una carga positiva de +1.
Grupo 2: Metales alcalinotérreos
El grupo 2 de la tabla periódica contiene los metales alcalinotérreos. Estos elementos incluyen el berilio (Be), magnesio (Mg), calcio (Ca) y otros. Los metales alcalinotérreos también son reactivos, pero son menos reactivos que los metales alcalinos. Tienen una tendencia a perder dos electrones para formar iones con una carga positiva de +2.
Grupo 17: Halógenos
El grupo 17 de la tabla periódica está formado por los halógenos. Estos elementos incluyen el flúor (F), cloro (Cl), bromo (Br), yodo (I) y astato (At). Los halógenos son altamente reactivos y tienden a ganar un electrón para formar iones con una carga negativa de -1.
Grupo 18: Gases nobles
El grupo 18 de la tabla periódica comprende los gases nobles. Estos elementos incluyen el helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y radón (Rn). Los gases nobles son conocidos por ser extremadamente estables y no reactivos debido a su configuración electrónica completa. Son gases monoatómicos en condiciones normales y se utilizan en diversas aplicaciones, como iluminación, láseres y superconductividad.
Estos son solo algunos ejemplos de los grupos principales en la tabla periódica. Cada grupo tiene características distintivas y propiedades químicas que los hacen únicos. El estudio de los grupos en la tabla periódica es fundamental para comprender las tendencias y los patrones en el comportamiento de los elementos.
¿Cuál es la línea del tiempo de la evolución de la tabla periódica?
La línea del tiempo de la evolución de la tabla periódica es una representación cronológica de los hitos importantes en el desarrollo y la comprensión de la tabla periódica a lo largo de la historia. A continuación, se destacan algunos de los eventos más significativos en la evolución de la tabla periódica:
Siglo XIX: Los primeros intentos
En la primera mitad del siglo XIX, varios científicos, como Johann Wolfgang Döbereiner, John Newlands y Julius Lothar Meyer, realizaron intentos de clasificar los elementos conocidos en función de sus propiedades químicas y establecer relaciones entre ellos. Estos primeros intentos sentaron las bases para el desarrollo posterior de la tabla periódica.
1869: Tabla periódica de Dmitri Mendeléyev
En 1869, el químico ruso Dmitri Mendeléyev presentó su versión de la tabla periódica, que se considera uno de los hitos más importantes en la historia de la química. Mendeléyev organizó los elementos conocidos en función de sus propiedades químicas y físicas, y dejó espacios vacíos para elementos que aún no se habían descubierto. Su tabla periódica también permitía predecir las propiedades de los elementos aún desconocidos.
Siglo XX: Descubrimiento de nuevos elementos y refinamiento de la tabla periódica
A lo largo del siglo XX, se descubrieron nuevos elementos y se realizaron avances en la comprensión de la estructura atómica. Científicos como Glenn T. Seaborg y su equipo descubrieron numerosos elementos sintéticos y propusieron ajustes y mejoras en la tabla periódica de Mendeléyev.
Actualidad: La tabla periódica moderna
En la actualidad, la tabla periódica se ha refinado y actualizado constantemente a medida que se descubren nuevos elementos y se profundiza en el conocimiento de las propiedades atómicas y moleculares. La tabla periódica moderna, basada en la configuración electrónica y el número atómico, es un recurso esencial en la química y otras disciplinas científicas.
La línea del tiempo de la evolución de la tabla periódica muestra cómo ha evolucionado el entendimiento de los elementos y su organización a lo largo de los años. Cada descubrimiento y avance ha contribuido a una comprensión más profunda de la materia y ha enriquecido nuestra visión de la tabla periódica.
¿Cuáles son las familias más importantes en la tabla periódica?
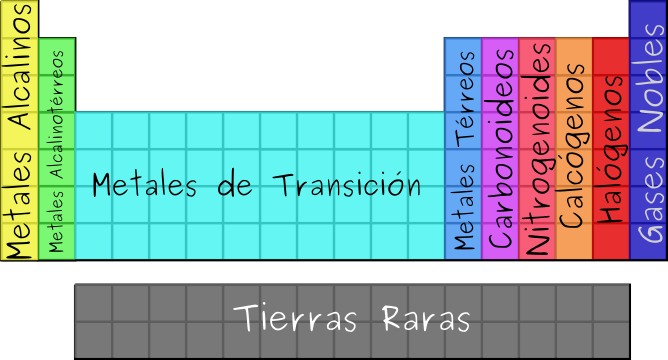
La tabla periódica está compuesta por diferentes familias o grupos de elementos que comparten características y propiedades químicas similares. A continuación, se describen algunas de las familias más importantes en la tabla periódica:
Familia de los metales alcalinos (Grupo 1)
La familia de los metales alcalinos está compuesta por los elementos que se encuentran en el Grupo 1 de la tabla periódica: hidrógeno (H), litio (Li), sodio (Na), potasio (K), entre otros. Estos elementos son altamente reactivos y tienden a perder un electrón para formar iones con una carga positiva de +1. Son metales blandos, de baja densidad y buenos conductores de electricidad y calor.
Familia de los metales alcalinotérreos (Grupo 2)
La familia de los metales alcalinotérreos incluye los elementos del Grupo 2 de la tabla periódica, como berilio (Be), magnesio (Mg), calcio (Ca), entre otros. Estos elementos también son reactivos, pero menos reactivos que los metales alcalinos. Tienen una tendencia a perder dos electrones para formar iones con una carga positiva de +2. Son metales relativamente blandos, de mayor densidad que los metales alcalinos y buenos conductores de electricidad y calor.
Familia de los halógenos (Grupo 17)
La familia de los halógenos está compuesta por los elementos del Grupo 17 de la tabla periódica, como flúor (F), cloro (Cl), bromo (Br), yodo (I) y astato (At). Estos elementos son altamente reactivos y tienden a ganar un electrón para formar iones con una carga negativa de -1. Son no metales, de baja reactividad química y se encuentran en distintos estados físicos.
Familia de los gases nobles (Grupo 18)
La familia de los gases nobles incluye los elementos del Grupo 18 de la tabla periódica, como helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y radón (Rn). Estos elementos son conocidos por su baja reactividad química debido a su configuración electrónica completa. Son gases monoatómicos en condiciones normales y se utilizan en diversas aplicaciones, como iluminación, láseres y superconductividad.
Estas son solo algunas de las familias más importantes en la tabla periódica. Cada familia tiene características y propiedades únicas que las distinguen y que son fundamentales para comprender el comportamiento de los elementos.
¿Cuál es la historia y el origen de la tabla periódica?
La historia de la tabla periódica es un viaje fascinante a través de los siglos, que refleja el progreso de la ciencia y la comprensión humana de los elementos y sus propiedades. A continuación, se presenta un resumen de la historia y el origen de la tabla periódica:
Antecedentes históricos
El estudio de los elementos se remonta a la antigüedad, cuando los filósofos griegos como Empédocles y Demócrito propusieron la existencia de cuatro elementos básicos: tierra, aire, fuego y agua. Sin embargo, estos conceptos no se basaban en una comprensión científica rigurosa.
Primeros intentos de clasificación
En el siglo XVII, alquimistas y científicos como Robert Boyle y Antoine-Laurent de Lavoisier comenzaron a realizar experimentos y a clasificar los elementos conocidos en función de sus propiedades químicas. Sin embargo, no se logró una clasificación sistemática y completa en esta etapa.
Tablas de triadas y octavas
En el siglo XIX, varios científicos, como Johann Wolfgang Döbereiner, John Newlands y Julius Lothar Meyer, propusieron diferentes sistemas de clasificación de los elementos. Döbereiner propuso las «triadas», grupos de tres elementos con propiedades químicas similares, mientras que Newlands observó una relación de «octavas» entre los elementos. Sin embargo, estos sistemas tenían limitaciones y no lograron una clasificación completa y coherente.
Tabla periódica de Dmitri Mendeléyev
En 1869, el químico ruso Dmitri Mendeléyev presentó su versión de la tabla periódica, que se considera uno de los hitos más importantes en la historia de la química. Mendeléyev organizó los elementos conocidos en función de sus propiedades químicas y físicas, y dejó espacios vacíos para elementos que aún no se habían descubierto. Su tabla periódica también permitía predecir las propiedades de los elementos aún desconocidos.
Evolución y refinamiento
A lo largo del siglo XX, la tabla periódica fue refinada y mejorada a medida que se descubrieron nuevos elementos y se profundizó en la comprensión de la estructura atómica. Científicos como Glenn T. Seaborg y su equipo descubrieron numerosos elementos sintéticos y propusieron ajustes y mejoras en la tabla periódica de Mendeléyev.
Tabla periódica moderna

En la actualidad, la tabla periódica se basa en la configuración electrónica y el número atómico de los elementos. Se han establecido acuerdos internacionales sobre la nomenclatura y la organización de la tabla periódica. La tabla periódica moderna es un recurso esencial en la química y otras disciplinas científicas, y sigue siendo objeto de investigación y exploración.
La historia y el origen de la tabla periódica reflejan el esfuerzo y la colaboración de numerosos científicos a lo largo de los siglos. La tabla periódica actual es el resultado de décadas de investigación y descubrimientos, y sigue siendo una herramienta fundamental en la comprensión de los elementos y sus propiedades.
¿Cuáles son los metales presentes en la tabla periódica?
La tabla periódica está compuesta por una amplia variedad de elementos, y muchos de ellos son metales. Los metales se caracterizan por ser buenos conductores de electricidad y calor, tener un brillo metálico y ser generalmente sólidos a temperatura ambiente (excepto el mercurio). A continuación, se enumeran algunos de los metales presentes en la tabla periódica:
- Aluminio (Al): Un metal liviano y resistente ampliamente utilizado en la industria y la construcción.
- Calcio (Ca): Un metal alcalinotérreo esencial para la formación y el mantenimiento de huesos y dientes.
- Cobre (Cu): Un metal conductor ampliamente utilizado en aplicaciones eléctricas y electrónicas.
- Hierro (Fe): Un metal muy común y esencial para la fabricación de acero.
- Magnesio (Mg): Un metal alcalinotérreo utilizado en aleaciones y en la industria aeroespacial.
- Plata (Ag): Un metal precioso conocido por su brillo y conductividad eléctrica.
- Oro (Au): Un metal precioso altamente valorado por su belleza y resistencia a la corrosión.
- Platino (Pt): Un metal raro utilizado en joyería, electrónica y aplicaciones químicas.
- Zinc (Zn): Un metal utilizado en la galvanización para proteger otros metales de la corrosión.
Estos son solo algunos ejemplos de los metales presentes en la tabla periódica. La tabla periódica también incluye otros metales como el níquel, el estaño, el plomo, el tungsteno, el mercurio y muchos más. Los metales desempeñan un papel fundamental en nuestra vida diaria y en numerosas industrias debido a sus propiedades únicas.